低鹽發酵甜瓣子體系中產生物胺的菌株與降解菌株能力研究【上】
甜瓣子發酵將為豆瓣醬提供豐富的游離氨基酸、有機酸、揮發性風味物質及多種發酵微生物,是郫縣豆瓣生產的重要階段之一。目前,甜瓣子多采用高鹽度發酵,發酵的鹽度通常為12%~17%,成品豆瓣醬的鹽度高達16%~20%[1]。研究表明攝入過量的鹽分,可能會引起心腦血管、高血壓等疾病[2]。目前我國每人每天平均膳食鹽攝入量為(14.53±11.04)g[3],遠超過世界衛生組織(WHO)推薦攝入量5 g/d。豆瓣醬等高鹽調味品為我國膳食鹽分攝入的主要來源,低鹽化已成為其發展的必然趨勢。對甜瓣子發酵低鹽化的研究具有重要意義。
低鹽發酵甜瓣子因體系鹽度較低,其游離氨基酸種類及含量相對較多,且發酵體系pH值相對較低,故極易造成生物胺等有害物質積累[4]。生物胺是氨基酸在氨基酸脫羧酶的作用下脫羧生成的一類堿性次生代謝產物,過量攝入將造成一定的安全風險[5-6]。使用生物技術控制發酵食品中生物胺含量已有較廣泛的研究,如Kung等[7]、OH等[8]、Guo等[9]均對發酵食品中降解生物胺微生物進行篩選,并研究相關菌株的降解生物胺能力。然而,針對低鹽發酵甜瓣子體系中產生物胺的菌株及降解菌株的研究相對較少。本研究采用熒光檢測定性分析和高效液相色譜法定量分析,篩選甜瓣子中產生物胺和降解生物胺的菌株,并進行回接驗證,分析含鹽量和降胺菌株對甜瓣子產品安全性的影響,以期為低鹽甜瓣子生物胺含量的控制提供參考。
1試驗材料
1.1試劑與儀器
丹磺酰氯、1,7-二氨基庚烷、脯氨酸、鳥氨酸、精氨酸、賴氨酸、酪氨酸、苯丙氨酸、色氨酸、組氨酸、5-磷酸吡哆醛、硫胺素均為化學純,上海源葉生物科技集團股份有限公司;腐胺、尸胺、酪胺、苯乙胺、組胺、色胺、精胺、亞精胺均為色譜純,上海源葉生物科技集團股份有限公司;氯化鈉、乙腈、乙醚、七水合硫酸鎂、硫酸錳、硫酸亞鐵、磷酸氫二鉀均為分析純,成都科隆化工有限公司;Ezup柱式真(細)菌基因組DNA抽提試劑盒,生工生物工程股份有限公司。
126-Ⅱ高效液相色譜,安捷倫科技有限公司;凝膠成像儀,君意電泳有限公司;H2050R-1離心機,長沙高新技術產業開發區湘儀離心機儀器有限公司;DZKW-4恒溫水浴鍋,北京中興偉業儀器有限公司;ESJ200-4A型分析天平,沈陽龍騰電子有限公司;SPX-150B-4生化培養箱,上海博訊實業有限公司醫療設備廠;THZ-82水浴恒溫振蕩器,常州市中貝儀器有限公司;GeneAmpR9700型PCR儀,美國ABI公司。
1.2試驗所用培養基
生物胺顯色培養基:參考Sara等[10]方法略作修改后配制;以生物胺為唯一氮源培養基(BAs):參考趙佳迪[11]的方法,略作修改后配制。
6%/9%/12%鹽度甜瓣子模擬體系(以100 mL計):霉瓣子25 g+鹽4.5,9.4,13 g+5-磷酸吡哆醛0.005 g+碳酸鈣0.01 g+70 g水,混勻121℃,15 min滅菌。
6%鹽度含生物胺的甜瓣子模擬體系(以100 mL計):霉瓣子25 g+鹽4.5 g+4 mL生物胺100 mg/L(8種)+5-磷酸吡哆醛0.005 g+碳酸鈣0.01 g+70 g水,混勻121℃,15 min滅菌。
2試驗方法
2.1甜瓣子中產生物胺菌株篩選及其不同鹽度下產胺能力研究
2.1.1產胺菌株篩選稱取200 g霉瓣子,加入200 g飲用水,稱取16 g食用鹽,整個甜瓣子發酵體系的鹽度為4%,37℃發酵30 d。稱取10 g 4%鹽度甜瓣子,用生理鹽水逐級稀釋。選取適宜梯度的稀釋液100μL分別涂布于含有溴甲酚紫的固體顯色培養基上,37℃培養12 h。挑取培養后使培養基變紫的菌株至LB培養基上分離、純化即為初篩菌株。將初篩菌株接種至液體顯色培養基進行復篩,以不接種菌株的顯色培養基為空白對照。37℃過夜培養,挑選培養后培養液明顯變紫的菌株初步判定為產生物胺的菌株。采用生工生物工程股份有限公司基因組DNA提取試劑盒提取DNA后,分別利用PCR擴增16S rDNA、18S rDNA和ITS序列,送至北京擎科新業生物技術有限公司進行測序,通過BLAST比對序列,構建系統發育樹。
2.1.2高效液相色譜法測定生物胺含量參考陳功等[12]建立的HPLC測定不同樣品生物胺含量的方法,略作修改,洗脫程序如表1所示。
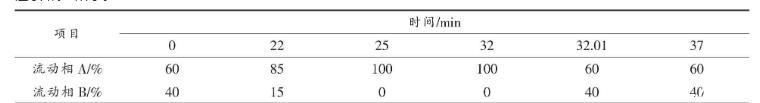
表1生物胺檢測的洗脫程序
采用HPLC測定樣品生物胺含量,建立標準曲線,根據標準曲線計算試樣中生物胺的含量,所得含量明顯高于空白組的菌株即確定為產生物胺菌株。
2.1.3高產生物胺菌株回接至不同鹽度甜瓣子體系產生物胺能力研究將篩選得到高產生物胺的菌株回接于液體培養基(1 L)中,擴大培養24 h,8 000 r/min,4℃低溫離心10 min得到菌體,以108CFU/g回接至不同鹽度甜瓣子(6%,9%,12%)模擬體系中;以接種等量無菌水的滅菌甜瓣子模擬體系為空白對照,以該鹽度未滅菌甜瓣子接種等量無菌水為正常發酵甜瓣子對照,30℃恒溫發酵16 d后,測定甜瓣子中生物胺含量。
2.2生物胺降解菌株篩選及降解能力研究
2.2.1不產生物胺菌株篩選選取46株課題組前期從甜瓣子中篩出的不同菌屬菌株為研究對象,分別活化后接種至生物胺液體顯色培養基中,以接種等量無菌水為空白對照。恒溫培養48 h后,挑選顯色培養基不變紫的菌株初步判定為不產生物胺菌株。
2.2.2降解生物胺菌株篩選及其降解能力測定根據生物胺在熒光條件發色,生物胺含量與特定波長下熒光強度呈正相關原理,參考Judite等[13]方法略作調整后,建立熒光定性分析樣品中生物胺含量的方法,初步篩選提取液熒光強度弱于空白對照的菌株為可能降解生物胺的菌株。將初篩得到的降解生物胺菌株接種到BAs培養液中,以接種等量無菌水的BAs培養液為空白對照,37℃振蕩培養12 h后,觀察其菌株生長情況并于620 nm波長下測定其OD值,測定菌株在以生物胺為唯一氮源的培養基中的生長情況。按上述方法對BAs培養液提取衍生后,再次測定熒光強度,選取熒光強度弱于空白對照組的菌株為降解生物胺菌株。高效液相色譜測定降胺菌株培養液中生物胺含量,并用公式(1)計算其生物胺降解率。
式中,X——生物胺降解率(%);C1——空白組中生物胺濃度(mg/kg);C2——接種菌株培養后培養液中生物胺濃度(mg/kg)。
2.2.3降解生物胺菌株回接甜瓣子模擬體系將篩選菌株回接到6%鹽度甜瓣子模擬體系中,以接種等量無菌水發酵體系為空白對照,30℃發酵30 d。根據表2甜瓣子感官評價標準對甜瓣子進行感官評分并采用高效液相色譜測定甜瓣子模擬體系中生物胺含量。

表2甜瓣子感官評價標準[14]
2.3數據分析
以上數據均做3個重復樣品,采用Excel、Origin、MEGA7對數據統計處理及作圖。
相關新聞推薦
1、香芹酚對惡臭假單胞菌生長、運動能力、產胞外蛋白酶和生物被膜能力影響(二)
3、三種抗菌藥物處理后持留菌株和抗藥菌株生長曲線、優勢的比較——摘要、材料與方法
